SPORT AND PROTIDES in collaborazione con ATLET
Ricapitolare'
Le proteine costituiscono una famiglia chimica eterogenea e sono considerate biomolecole di primaria importanza:
Quantitativamente, le proteine rappresentano dal 55 all'85% del peso secco. Sono il secondo elemento più comune nel corpo dopo l'acqua.
Qualitativamente, hanno un ruolo strutturale ma anche un ruolo funzionale vitale.
Salvo casi eccezionali (digiuno prolungato, riserve di glicogeno insufficienti, ecc.), le proteine non contribuiscono in modo significativo al fabbisogno energetico.
I nostri bisogni sono molto importanti in termini di proteine. La nostra organizzazione produce quasi 100 tipi diversi!
Tutte le proteine sono costituite da 20 diversi aminoacidi.
Tra questi, 8 sono aminoacidi essenziali (EAA): il corpo umano non sa come produrli. Il cibo deve quindi fornire loro e per di più nello stesso pasto. Perché se per produrre una delle sue proteine al corpo manca solo uno di questi 8 EAA, la produzione della proteina si interrompe, il corpo non sapendo come mettere da parte gli altri 7 in attesa che arrivi l'8°.
Le proteine animali forniscono tutti questi 8 EAA, a differenza delle proteine vegetali, che sono carenti in uno degli 8 EAA. I vegetariani devono quindi mangiare nello stesso pasto sia cereali (frumento, mais, riso, ecc.) a basso contenuto di lisina, sia legumi (lenticchie, ceci, ecc.) a basso contenuto di metionina.
La sintesi proteica è essenziale per lo sviluppo, la crescita, ma anche per il mantenimento della massa corporea. Se i carboidrati rappresentano la fonte essenziale di approvvigionamento energetico, l'esercizio fisico regolare aumenta notevolmente il fabbisogno giornaliero di composti azotati. In condizioni molto specifiche, è probabile che alcuni amminoacidi vengano ossidati per costituire così substrati energetici a pieno titolo. Tuttavia, tutte le proteine presenti nell'organismo svolgono un ruolo funzionale specifico e non ci sono aminoacidi immagazzinati e immagazzinati come carboidrati o lipidi. Se necessario, saranno quindi utilizzati gli amminoacidi derivati da proteine strutturali o funzionali, che potrebbero influenzare il funzionamento dell'organismo.
Quindi, in assenza di assunzione di proteine, il corpo si autocannibalizza e si autodigerisce!
L'assenza di proteine obbliga l'organismo ad attingerle dalle sue “riserve”: lo scioglimento dei muscoli (compreso il cuore) e poi dei visceri (intestinali, epatici, ecc.) è poi inevitabile!
Attingere alle riserve porta a carenze: le difese immunitarie si indeboliscono, la digestione e il transito rallentano, la guarigione fa male, la pelle invecchia...
Come spesso accade, le variazioni registrate nel metabolismo proteico sono strettamente legate al tipo di sport praticato e le problematiche poste saranno molto diverse a seconda che la disciplina sportiva considerata sia resistenza o forza-potenza. Tuttavia, nel range molto ampio che va dagli esercizi brevi e ad altissima intensità (esercizio anaerobico di tipo esplosivo) agli esercizi di lunga durata di tipo duraturo, le risposte del metabolismo proteico sono qualitativamente simili, associando un calo della sintesi proteica e aumento del degrado durante l'attività e viceversa durante il recupero...
Richiami di lezioni di biochimica...
Le proteine costituiscono una famiglia chimica eterogenea e sono considerate biomolecole di primaria importanza:
- quantitativamente, le proteine rappresentano dal 55 all'85% del peso secco. Sono il secondo elemento più comune nel corpo dopo l'acqua.
- qualitativamente, hanno un ruolo strutturale ma anche un ruolo funzionale vitale.
Salvo casi eccezionali (digiuni prolungati, diabete, ecc.), le proteine non contribuiscono in modo significativo al fabbisogno energetico.
Hanno un ruolo di supporto meccanico e di supporto tissutale, ad esempio il collagene, la proteina più abbondante nell'organismo; a livello cellulare, le proteine del citoscheletro (actina, tubulina) sono responsabili della forma cellulare.
Hanno un ruolo di catalizzatore biochimico, caso di enzimi senza i quali quasi tutte le reazioni chimiche sarebbero impossibili nell'organismo; ruolo di trasportatore sanguigno, l'albumina (che è la proteina plasmatica più importante, contribuisce al trasporto di acidi grassi liberi o di alcune vitamine) o l'emoglobina (situata nei globuli rossi, permette il trasporto di ossigeno e anidride carbonica); ruolo dei trasportatori di membrana, le proteine controllano quantitativamente e qualitativamente gli scambi tra la cellula e l'ambiente extracellulare, i trasportatori specifici del glucosio; ruolo di mediatori chimici come ormoni peptidici come insulina e glucagone; ruolo del recettore di membrana; ruolo nel mantenimento dell'integrità del corpo, immunoglobuline (anticorpi); ruolo del movimento, le proteine contrattili dei muscoli (actina e miosina).
Le proteine sono composti organici costituiti da carbonio (C), idrogeno (H), ossigeno (O) e azoto (N) a cui talvolta viene aggiunto zolfo (S). La loro struttura monomerica è l'amminoacido. A seconda dell'importanza della polimerizzazione e della composizione, è possibile distinguere diversi tipi di proteine:
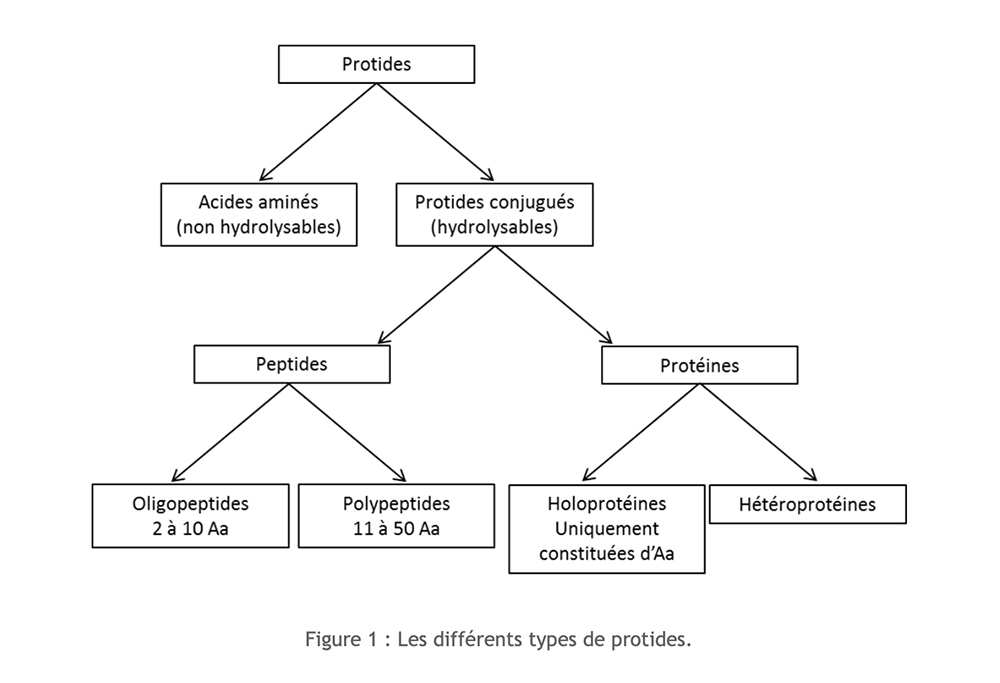
Aminoacidi
Gli amminoacidi hanno una struttura molecolare comune. Sono composti azotati.
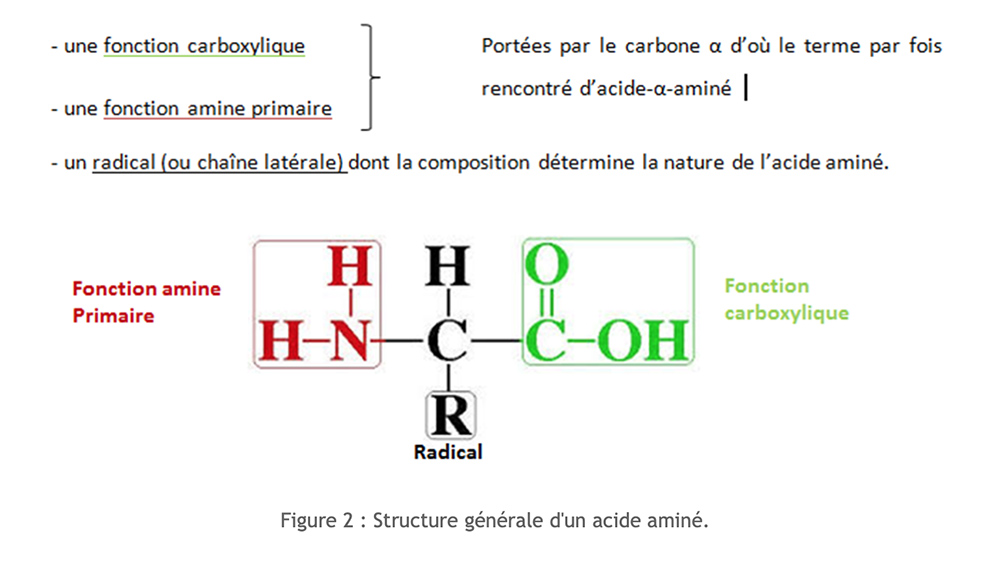
Sono elencati oltre 250 diversi aminoacidi. Tuttavia, tutte le nostre proteine sono costituite da un gruppo di 20 aminoacidi, che sono chiamatiamminoacidi standard.
Possiamo classificare questi amminoacidi in base alla natura della loro catena laterale. Per facilitare la scrittura degli amminoacidi si utilizza un codice di tre lettere o un codice di una lettera.
I diversi aminoacidi
Possiamo elencare otto aminoacidi essenziali negli adulti (Val, Leu, Ile, Thr, Met, Lys, Phe e Trp) più un nono nei bambini (His). Questi aminoacidi devono essere assolutamente presenti nella dieta.
- glicine (Gly o G).
- alanina (Ala o A), aminoacido molto comune nelle proteine.
- la Valle (Val o V).
- Leucina (Leu o L) e isoleucina (Ile o I) che non possono essere sintetizzati dall'organismo, fanno quindi parte degli aminoacidi essenziali.
- Serina (Ser o S).
- Treonina (Thr o T), che è un amminoacido essenziale.
- cisteina (Cys o C) contribuisce alla stabilizzazione della struttura terziaria delle proteine grazie alla formazione di ponti disolfuro. La cisteina è anche il precursore della taurina.
- Metionina (Met o M) che fa parte degli aminoacidi essenziali.
- Acido aspartico (Asp o D) e ilacido glutammico (Glu o E). Questi aminoacidi sono molto comuni nelle proteine. In quanto amminoacidi liberi, svolgono un ruolo importante nel metabolismo dell'azoto. L'acido glutammico funge anche da precursore per la formazione dell'acido γ-aminobutirrico (GABA), un mediatore del sistema nervoso centrale.
- asparagina (Asn o N) e glutammina (Gln o Q); hanno un ruolo importante nel metabolismo dell'azoto.
- lisina (Lys o K) è uno degli aminoacidi essenziali (si trova in particolare nel collagene).
- L'arginina (Arg o R) svolge un ruolo importante nel ciclo dell'urea e partecipa alla formazione della creatina.
- Istidina (His o H) è considerato un aminoacido essenziale nei bambini.
- Fenilalanina (Phe o F) è uno degli amminoacidi essenziali. Come suggerisce il nome, la sua struttura è quella dell'alanina sostituita da un gruppo fenilico, formando un radicale idrofobo. La sua idrossilazione dà tirosina (Tyr o Y). Questi due aminoacidi sono importanti perché fungono da precursori per la biosintesi delle catecolamine (le più comuni sono adrenalina, noradrenalina e dopamina). tirosina partecipa alla formazione degli ormoni tiroidei.
- Triptofano (Trp o W) è un amminoacido essenziale. È un precursore biosintetico della serotonina e della vitamina B3.
- Prolina (Pro o P). Come la lisina, ha la particolarità di essere idrossilata all'interno del collagene: l'idrossiprolina.
peptidi
I peptidi derivano dall'associazione di amminoacidi. Il legame risulta dalla condensazione tra la funzione carbossilica (del carbonio α) di un amminoacido e la funzione amminica (del carbonio α) di un secondo amminoacido. Questa condensazione è accompagnata dal rilascio di una molecola d'acqua.
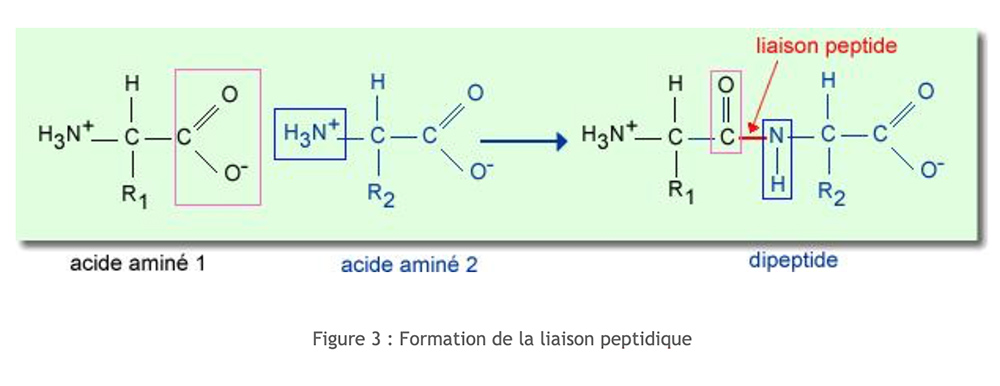
Questa disposizione elettronica induce un legame peptidico rigido e planare. Di conseguenza, non c'è rotazione tra C e N, che influenza notevolmente la struttura secondaria di peptidi e proteine.
Esempi di peptidi di interesse biologico
- Glutatione: Questo tripeptide svolge un ruolo importante a livello cellulare neutralizzando i radicali liberi, soprattutto nei globuli rossi. La sua sequenza è: γGlu-Cys-Gly.
- DHA: Questo peptide è sintetizzato dall'ipotalamo attraverso i suoi neuroni neurosecretori. Rilasciato a livello dell'ipofisi posteriore nel sangue, ha un ruolo ormonale: stimola il riassorbimento dell'acqua da parte del rene.
Assunzione di proteine ed esercizio fisico
Oggi è scientificamente dimostrato che il metabolismo delle proteine è influenzato dalla pratica dell'esercizio. Tuttavia, spesso diamo loro un ruolo troppo importante; La realtà nutrizionale è più misurata.
La sintesi proteica è essenziale per lo sviluppo, la crescita, ma anche per il mantenimento della massa corporea. La pratica regolare dello sport aumenta notevolmente il fabbisogno giornaliero di composti azotati ed in particolare in condizioni molto specifiche (esaurimento delle riserve di glicogeno, forte calo della glicemia, ecc.). Tuttavia, non immagazziniamo aminoacidi. Se necessario, saranno quindi utilizzati gli amminoacidi derivati da proteine strutturali o funzionali, che potrebbero influenzare il funzionamento dell'organismo.
Sport di resistenza: ossidazione degli aminoacidi e fabbisogno proteico
Se il fabbisogno di proteine rappresenta la quantità ottimale di proteine necessaria per assicurare tutta la sintesi proteica dell'organismo, per compensare l'ossidazione degli amminoacidi e le relative perdite dovute all'accelerazione del turnover delle proteine, possiamo facilmente concludere che la ripetizione di esercizi di resistenza induce un aumento del fabbisogno nutritivo di proteine e aminoacidi. L'esercizio a lungo termine induce cambiamenti significativi nel metabolismo delle proteine. Studi sperimentali dimostrano che questo tipo di pratica di resistenza è associata ad una drastica riduzione dei processi di sintesi proteica muscolare. Pertanto, nell'ambito dell'esercizio prolungato, se l'apporto di glucosio è insufficiente, si assiste ad un aumento della degradazione proteica con l'obiettivo di aumentare la disponibilità di aminoacidi che possono contribuire alla gluconeogenesi o entrare nel ciclo di Krebs per fornire energia nel forma di ATP. Infine, il il recupero di questo tipo di esercizio richiederà considerazione apporto proteico mirato.
Gli aminoacidi disponibili nel nostro organismo hanno diverse origini: derivano dall'assunzione con la dieta, risultano dalla proteolisi endogena, oppure sono sintetizzati de novo all'interno dell'organismo (per gli aminoacidi non essenziali). La disponibilità di aminoacidi essenziali dipende solo dall'assunzione con la dieta e dal loro livello di degradazione.
Escludendo l'esercizio, c'è un perfetto equilibrio tra degradazione (proteolisi) e sintesi proteica (proteosintesi).
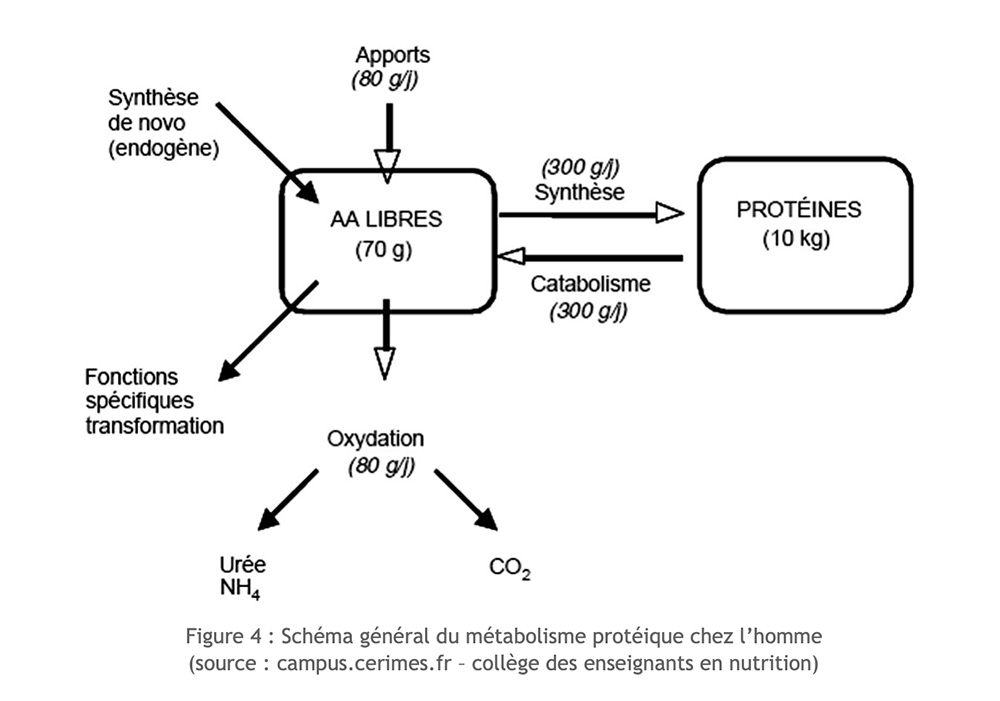
Ma nel contesto dell'esercizio a lungo termine, l'assunzione di azoto è ridotta, la sintesi proteica non può compensare il suo degrado e le atrofie della massa muscolare. Alcuni aminoacidi possono quindi essere considerati dei veri e propri substrati utili per il funzionamento muscolare. Sono usati ossidativamente. Tuttavia, solo pochi amminoacidi possono essere ossidati direttamente all'interno del muscolo scheletrico: si tratta essenzialmente di amminoacidi ramificati o ramificati (AAB: leucina, isoleucina, valina) e molto più incidentalmente aspartato, asparagina e prolina.
Le proteine nella nostra dieta
Le proteine del cibo non entrano mai direttamente nei nostri tessuti. Deve essere “degradato” in amminoacidi o dipeptidi. Una volta che la fase di digestione è avvenuta, gli aminoacidi ingeriti attraverso l'assunzione di cibo sono indistinguibili da quelli risultanti dalla degradazione delle proteine del corpo. Per sviluppare le proprie proteine, il nostro organismo attingerà dalla "sacca comune" dove si trovano tutti gli amminoacidi disponibili (quelli del cibo e quelli derivanti dalla distruzione delle proteine corporee), al tempo "t". . In una situazione ideale, la nostra razione dovrebbe fornire livelli ottimali di aminoacidi, in particolare gli otto essenziali.
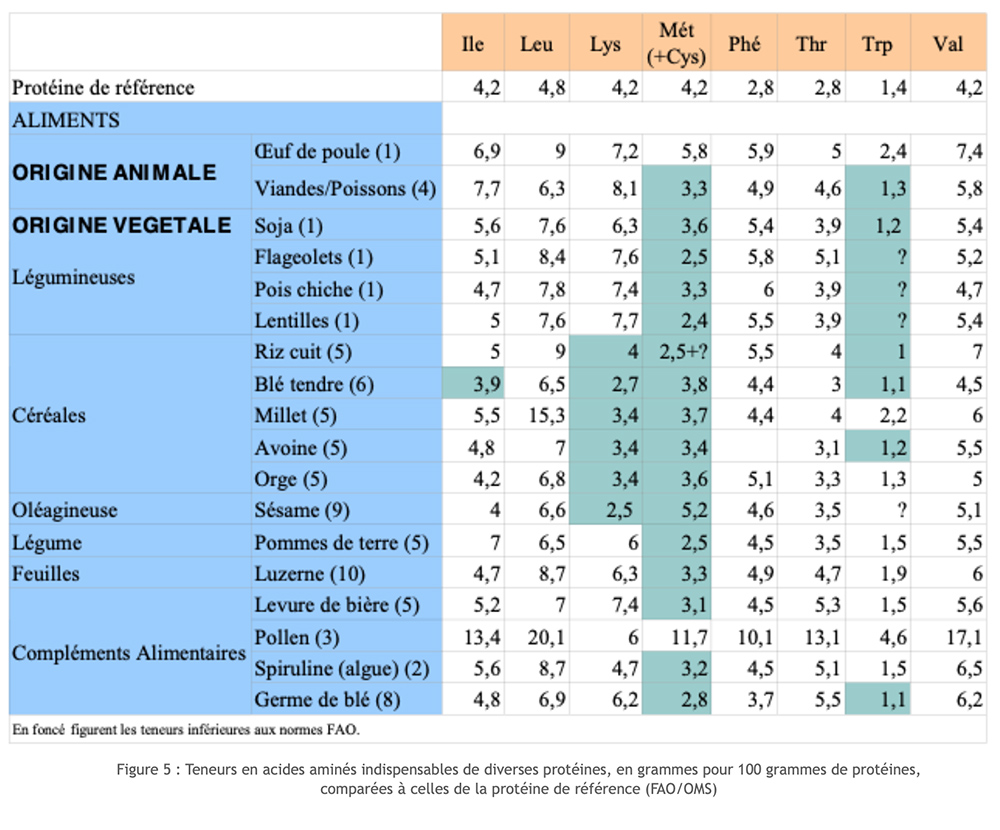
Le fonti animali di proteine ottengono un punteggio abbastanza buono sulle scale del valore biologico (BV) e del coefficiente di utilizzo digestivo (DUC). Questo è diverso per le proteine vegetali. Infatti, che si tratti di cereali o legumi, troviamo che alcuni degli aminoacidi essenziali sono forniti solo a livelli troppo bassi (fattore limitante). I cereali sono generalmente privi di lisina; i legumi e la soia hanno il fattore limitante metionina. Accoppiando le due fonti, riusciamo a ricostituire un set completo di AA essenziali, ma con un certo spreco! Inoltre, se questa scelta permette di prevenire carenze gravi e croniche per un AA essenziale, non garantisce il corretto andamento di tutti i metaboliti che comportano la partecipazione di aminoacidi nel lungo periodo. Questa insoddisfazione funzionale si riscontra in particolare con le sintesi dei neurotrasmettitori, in particolare quella della serotonina che dipende dal triptofano, aminoacidi molto spesso limitanti.
A questo si aggiunge il problema legato ai sistemi di assorbimento degli aminoacidi. Questi entrano nelle cellule attraverso le proteine recettrici nelle membrane cellulari. Esistono 4 famiglie di recettori per 20 aminoacidi. Si verificano infatti fenomeni di concorrenza. Pertanto, non è sufficiente fornire un amminoacido alla velocità corretta per essere sicuri che i processi risultanti avvengano correttamente. Gli aminoacidi concorrenti non devono essere trovati a una velocità troppo elevata, che ostacolerebbe l'assimilazione dei primi.
La composizione di aminoacidi grezzi di un pasto non ci consente di dedurre in che misura l'apporto di diversi aminoacidi sarà fornito in modo ottimale a ciascuna delle nostre cellule.
Quando mangi proteine, incorpori azoto nel tuo corpo. Quando si procede alla differenza dei due (ingresso meno uscita) si ottiene quello che viene chiamato il “bilancio dell'azoto”. Si registra un bilancio azotato positivo quando l'apporto di azoto supera la somma delle escrezioni urinarie, fecali e sudoripare. Un bilancio azotato positivo è necessario per garantire un livello di sintesi adeguato. È su questo metodo di analisi che vengono definiti i RNP (Raccomandazioni nutrizionali per la popolazione), che fanno riferimento ad una nozione essenzialmente quantitativa dei bisogni, e rispondono agli obiettivi di prevenzione delle carenze e di non intaccare la sintesi proteica.
Le raccomandazioni per gli appassionati di sport di resistenza sono consensuali: da 1,2 a 1,5 g/kg/giorno.
Quindi, per una persona che pesa 70 kg, l'assunzione di proteine consigliata è compresa tra: 84 g/giorno e 105 g/giorno; ciò equivale, ad esempio, a grandissime quantità di carne: da 465 a 580 g! Da qui l'interesse a consumare altre fonti proteiche (cereali, legumi, ecc.), o concentrati mirati al recupero precoce. Ancora una volta, consigliamo di adottare una dieta quotidiana varia ed equilibrata, adeguata al livello di allenamento.
Negli atleti le esigenze legate al rinnovamento funzionale sono aumentate, in determinate condizioni, per il catabolismo delle proteine, che interessano in particolare gli elementi contrattili del muscolo (soprattutto nei corridori, per l'onda d'urto che esercita un effetto distruttivo ripetendosi stesso ogni volta che il piede preme a terra). Questi processi aumentano le perdite e si sommano a quelli che corrispondono all'uso energetico di alcuni aminoacidi. Di conseguenza, dopo un test pedonale di 100 km è possibile osservare una perdita del livello plasmatico della maggior parte degli aminoacidi e un aumento dell'escrezione urinaria di azoto.
Ma attenzione, l'uso crescente di integratori proteici "non mirati" può aumentare significativamente il fabbisogno; infatti, la velocità di sintesi è fissata dalla disponibilità dell'amminoacido meno presente nei tessuti. Ciò significa che se gli aminoacidi ramificati hanno visto diminuire il loro livello in risposta all'esercizio, le sintesi effettuate nel post sforzo saranno proporzionali alle quantità residue di leucina, isoleucina e valina.
Alcuni aminoacidi agiscono come molecole in grado di stimolare la sintesi proteica. La leucina è in grado di stimolare in modo specifico la sintesi proteica nei muscoli e nel fegato, anche in condizioni sfavorevoli (Cfr.: Buse MG, Reid M (1975): Leucina, un possibile regolatore del turnover proteico nel muscolo. J Clin. Invest., 58 : 1250).
L'assunzione di integratori proteici ricchi di aminoacidi ramificati consente quindi di evitare l'atrofia muscolare nonché il deterioramento di un certo numero di parametri fisici, psicologici e fisiologici (Cfr.: Degoutte F, Jouanel P & Coll (2006): Food restrizione e prestazioni, cambiamenti biochimici, psicologici ed endocrini negli atleti di judo.Int. J. Sport Med., 27 (1): 9 – 18.).
Oltre agli aminoacidi ramificati, altri due ci sembrano da non trascurare nella razione dell'atleta:
Metionina (fattore limitante per legumi e soia):
La presenza di metionina (Met) ad un livello ottimale condiziona l'andamento di un gran numero di reazioni che sono condizionate anche dal livello di apporto energetico. Infatti, come abbiamo visto sopra, Met può contribuire a fornire energia ai tessuti in una situazione di emergenza. Questo viene fatto tramite il ciclo di Krebs a spese di altri interventi metabolici Met. Pertanto, qualsiasi diminuzione dell'assunzione alimentare di Met porta ad un rallentamento di queste diverse vie, in particolare quella della gluconeogenesi, e questo, al fine di mantenerne il livello minimo nelle cellule. Inoltre, la trasformazione del Met in cisteina per favorire la formazione del glutatione (partecipando alla cascata antiradicalica), è rallentata a favore dell'apporto di energia, oppure non può aver luogo.
Glutammina, Glicina e Aspartato:
Il nostro capitale energetico si basa sulla molecola di DNA che ha la forma di una doppia elica (un doppio filamento). L'RNA, d'altra parte, è un polimero a filamento singolo simile al DNA. Il DNA immagazzina le informazioni genetiche nella cellula, mentre l'RNA viene utilizzato per trasmettere informazioni di codifica all'esterno del nucleo cellulare e quindi per sintetizzare le proteine da queste informazioni. Le basi che compongono l'RNA sono fornite in piccole quantità dal cibo, la maggior parte proviene infatti da sintesi effettuate nelle cellule. Questi sono costituiti da aminoacidi, alcuni dei quali sono disponibili solo in quantità limitate. Il capitale genetico e le proteine sono quindi strettamente dipendenti. I precursori sono: glutammina, glicina e aspartato. La glutammina è tanto più coinvolta in quanto contiene 2 molecole di azoto. La sua disponibilità è quindi fondamentale nelle situazioni in cui è essenziale una rapida moltiplicazione cellulare (risposta immunitaria, guarigione, ecc.). Qui la presenza di cofattori enzimatici come lo zinco, le vitamine B9, B12 (solo di origine animale) e B6 si rivela determinante per il regolare svolgimento del processo di sintesi.
Pertanto, qualsiasi deficit o squilibrio nell'assunzione di questi aminoacidi, e in particolare della glutammina, influenzerà il recupero, la risposta all'attività.
Questi diversi punti rendono molto complesso definire un apporto proteico ideale/ottimale. La raccomandazione, vista sopra, tiene conto di possibili disturbi funzionali al fine di adattare il pescato, sia quantitativamente che qualitativamente, alla diversità. Gli integratori costituiscono solo piccoli riaggiustamenti della razione e sono costituiti da peptidi altamente digeribili e mirati. Non devono, in nessun caso, compensare comprovate carenze nutrizionali. A volte ritenute superflue, sembra però che siano accompagnate da un miglioramento dello stato di salute dell'atleta interessato.
Articolo scritto per il nostro partner Atlet da:
Caroline JOUCLA • Nutrizionista-dietista certificata dallo Stato • www.carolinejoucladieteticienne.com
